Info Petani -
PUDJIATMOKO
Balai Pengujian Mutu dan Sertifikasi Obat Hewan
Balai Pengujian Mutu dan Sertifikasi Obat Hewan
(National Veterinary Drug Assay Laboratory)
Gunungsindur, Bogor 16340, Indonesia
ABSTRACT
The ompA-recombinant protein produced by E. coli BL21 (DE3)plysS containing pRSETA/ompA gene of feline Chlamydia psittaci B 166 strain was purified using method of Xpress system protein purification (Invitrogen BV, The Netherlands). To eliminate guanidine hydrochloride, the suspension of ompA-recombinant protein was dialyzed in 20 mM Tris pH 7.8, glycerol 10% and phenylmethylsulfonyl fluoride containing 0,1 M MgCI2 CaCl2, NaCI or KCI. To prepare the vaccines, the purified proteins were emulsified with oil adjuvant. One ml of each vaccine was injected intramuscularly to 4 spesific pathogen free rats 8-week-old. The second vaccination was performed at 3 weeks post first vaccination. IgG antibody titer against feline Chlamydia psittaci was measured using microimmunofluorescence test at a week post second vaccination. Vaccination using ompA-recombinant could initiate IgG antibody in 21 of 24 vaccinated rats. IgG antibody titer or rats vaccinated with materials dialyzed in dialysis buffer containing KCl has highest titer ranged from 1:16 to 1:64, and its geometric mean titer is 1 :38. The results of the present study indicate that the ompA-recombinant protein of chlamydia used for main component of vaccine may initiate antibody against feline C. psittaci in rats.
Key words: Chlamydia, cat, ompA, rat, vaccine
ABSTRAK
Protein ompA-recombinan yang dihasilkan oleh E. coli BL21(DE3)plysS yang mengandung rekombinan plasmid pRSETA/gen ompA feline Chlamydia psittaci galur B 166 dimurnikan dengan cara Xpress system protein purification (Invitrogen BV, The Netherlands). Untuk menghilangkan guanidine hydrochloride, suspensi ompA-rekombinan didialisis dengan larutan dapar 20 mM Tris pH 7,8, glycerol 10% dan phenylmethylsulfonyl fluoride yang mengandung 0, I M MgCI2, CaCI2, NaCI atau KCI. Tiap-tiap protein yang telah dimurnikan tersebut diemulsikan dengan adjuvan minyak untuk dijadikan vaksin. Satu ml tiap-tiap vaksin tersebut disuntikan secara intramuskular pada 4 ekor tikus putih specific pathogen free (SPF) umur 8 minggu. Vaksinasi kedua dilakukan 3 minggu setelah vaksinasi pertama. Seminggu setelah penyuntikan kedua titer antibodi IgG diukur dengan microimmunofluorescence test. Vaksinasi menggunakan protein ompA-rekombinan feline C. psittaci ini bisa merangsang terbentuk antibodi IgG pada 21 dari 24 tikus yang divaksin. Titer antibodi IgG tikus yang divaksin dengan material yang didialisis dengan larutan dapar yang mengandung KCl mempunyai titer tertinggi berkisar antara 1:6 dan 1:64 dengan geometric mean titer 1:38. Dari hasil-hasil penelitian ini menunjukkan bahwa protein ompA-rekombinan Chlamydia yang digunakan sebagai komponen utama vaksin bisa merangsang timbulnya antibodi terhadap C. psittaci pada tikus putih.
Kata kunci : Chlamydia, kucing, ompA, tikus, vaksin
PENDAHULUAN
Feline Chlamydia psittaci adalah bakteri Gram negative yang merupakan parasit obligate intracellular yang menyerang kucing (Moulder et aI., 1984) yang menyebabkan conjuctivitis, rhinitis dan pneumonia (Hoover et aI., 1978, Johnson, 1984, Baker et aI., 1942). Organisme tersebut merupakan salah satu kelompok genetik genus Chlamydia yang diajukan sebagai spesies baru (Pudjiatmoko et aI., 1997) dan kemudian dinamakan Chlamydophyla felis (Everett et aI., 1999).
Dalam menanggulangi penyakit Chlamydiosis pada manusia telah digunakan chlamydia utuh sebagai vaksin inaktif yang diberikan secara intramuskuler, .tetapi masa proteksi yang diperoleh singkat dan vaksinasi dengan cara ini bisa menimbulkan sakit yang lebih parah selama masa infeksi berikutnya, hal ini mungkin disebabkan reaksi patogen terhadap antigen Chlamydia tertentu (Grayston dan Wang, 1978; Grasyton dan Wang, 1975).
Pada studi sebelumnya menunjukan bahwa E. coli BL21(DE3)plysS yang mengandung rekombinan ompA-pRSETA bisa memproduksi protein ompA-rekombinan 40 kDa yang bisa bereaksi dengan antibodi monoclonal major outer membrane protein (MOMP) C. psittaci G-IB6 dan protein rekombinan tersebut diusulkan untuk digunakan sebagai salah satu komponen utama vaksin chlamydiosis pada kucing (Pudjiatmoko, 1999a).
Vaksin menggunakan immunogene ompA- rekombinan diharapkan akan lebih cepat, mudah dan ekonomis dalam mempersiapkan immunogene dan bisa menghindari efek samping vaksin Chlamydia utuh. Penelitian kali ini bertujuan mempelajari respon immunigenisitas vaksin ompA-rekombinan feline C. psittaci pada tikus putih.
BAHAN DAN METODE
Ekspresi Protein ompA-rekombinan
Prosedur untuk memproduksi protein ompA rekombinan dilakukan seperti pada studi awal pembuatan vaksin feline chlamydiosis sebelumnya (Pudjiatmoko, 1999a), gen ompA feline C. psittaci galur B166
(Gambar 1) disisipkan pada vektor plasmid pRSETA yang mengandung 6 tandem residu histidine (invitrogen BV, The Netherland) (Gambar 2) pada tempat restriksi antara enzim BamHI dan XhoI. Plasmid rekombinan pRSETA/gen ompA feline C. psittaci ditransformasikan ke dalam E. coli BL21 (DE3)plysS dengan ciri-ciri genotipe F, ompT hsdSB (rB mB) gal dcm (DE3) plysS (CamR). E. coli yang telah memperoleh rekombinan pRSETA-ompA tersebut dibiakan pada media Terrific broth (TB) yang mengandung 10 µg/ml Carbenicillin dan 34 µg/ml Chloramphenicol. Ekspresi gen ompA diinduksi dengan cara menambahkan 1,0 mM Isopropyl-ß-D-thiogalactopyranoside (IPTG) ke dalam biakan tersebut pada suhu 37 C. Sebelum dilakukan pengecekan protein ompA-rekombinan, E. coli BL21(DE3)plysS dilisis dengan menggunakan French pressure cell yang dioperasikan pada tekanan 16.000 - 18.000 Lb/inz (Hopkins, 1992).
Pembuatan Vaksin
Protein ompA-rekombinan dimurnikan dengan column yang berisi resin ProBondTM menggunakan Xpress system protein purification (Invitrogen BV, The Netherlands). Sel E. coli BL21(DE3)plysS yang telah dipanen dilisis dengan 10 ml guanidium lysis buffer (6M guanidine hydrochloride, 20 mM sodium phosphate, 500 mM sodium chloride, pH 7,8) selama 10 menit. Untuk menguraikan DNA dan RNA, suspensi sel E. coli disonikasi dengan frekuensi tinggi selama 10 detik tiga kali. Supematan dikumpulkan setelah pemusingan pada 3.000 x g selama 15 menit.
Sepuluh ml supernatan tersebut diaplikasikan pada column yang telah dialiri dengan denaturing binding buffer (8M urea, 20 mM sodium phosphate, 500 mM sodium chloride, pH 7,8). Protein ompA-rekombinan dipisahkan dengan denaturing elution buffer (8M urea, 20 mM sodium phosphate, 500 mM sodium chloride, pH 4,0) setelah dilakukan pencucian terlebih dahulu dengan denaturing washing buffer (8M urea, 20 mM sodium phosphate, 500 mM sodium chloride, pH 6,0 dan pH 5,3).
Protein ompA-rekombinan ini dibagi menjadi 4 bagian dengan volume yang sarna, masing-masing bagian dimasukkan ke dalam seamless cellulose tube (Viskase sales corp., Japan) dan didialisis menggunakan larutan dapar 20 mM Tris pH 7,8, glycerol 10% dan phenylmethylsulfonyl fluoride (PMFS) dimana setiap larutan dapar terse but mengandung 0,1 M MgCI2, CaCl2, NaCI atau KCl. Setelah dialisis, material dipusing 10.000 x g selama 10 menit. Pelet dan supematan dipisahkan dan disuspensikan dengan larutan dapar yang sama sehingga mengandung protein 1 µg/ml.
Untuk kontrol positif digunakan Feline C. psittaci galur Fe/145. Chlamydia dibiakan pada sel SL pada suhu 37°C selama 4 hari, setelah dipanen Chlamydia diencerkan dengan sucrose-phosphate-glutamic acid (SPG) sehingga diperoleh suspensi chlamydia 10 pangkat 7,0 ELD50 per ml. Chlamydia diinaktifkan dengan formalin sehingga konsentrasi akhir 0.1 % selama 3 hari pada suhu 37°C.
Chlamydia yang telah diinaktifkan atau suspensi protein OmpA-rekombinan yang telah dimurnikan tersebut diemulsikan dengan adjuvan minyak yang terdiri dari minyak mineral (parafin cair) dan emulgator sorbitan mono-oleat. Vaksin disimpan pada suhu 4°C sampai dengan saatnya digunakan.
Vaksinasi pada Tikus Putih
Hewan percobaan yang digunakan dalam penelitian ini tikus putih bebas patogen tertentu (specific pathogen free,SPF') umur 8 minggu diperoleh dari Kyoto Biken Laboratories, Jepang. Tigapuluh dua ekor tikus dibagi menjadi 8 kelompok (Kelompok A, B, C, D, E, F, G, dan H) sehingga tiap kelompok terdiri dari 4 ekor. Setiap ekor tikus disuntik secara intramuskuler dengan 1,0 ml vaksin yang mengandung immunogen seperti tertulis pada Tabel I. Penyuntikan diulang pada tiga minggu setelah penyuntikan pertama. Tikus dari kelompok A divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari supematan yang didialisis dengan larutan dapar yang mengandung 0,1 M MgCl2 (supematan MgCl2), kelompok B divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari supernatan yang didialisis dengan larutan dapar yang mengandung 0,1 M NaCI (supernatan-NaCl), kelompok C divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari supernatan yang didialisis dengan larutan dapar yang mengandung 0,1 M KCI (supernatan-KCl), kelompok D divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari pelet yang didialisis dengan larutan dapat yang mengandung 0,1 M MgCl2 (Pelet-MgCl2), kelompok E divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari pelet yang didialisis dengan larutan dapar yang mengandung 0,1 M NaCl (Pelet-NaCl), kelompok F divaksin dengan vaksin yang mengandung protein ompA-rekombinan dari pelet yang didialisis dengan larutan dapar yang mengandung 0,1 M KCl (pelet-KCl), dan Kelompok G divaksin dengan feline Chlamydia galur Fe/145 sebagai kontrol positif. Sedangkan kelompok H disuntik secara intramuskuler dengan campuran E. coli BL21(DE3)plysS tanpa ompA-rekombinan dan adjuvan sebagai kontrol negatif.
Microimmunofluorescence Test
Sampel serum tikus putih dikumpulkan pada saat sebelum vaksinasi dan seminggu setelah vaksinasi kedua (booster). Microimmunofluorescence test dilakukan mengikuti prosedur penelitian sebelumnya (Pudjiatmoko et al., 1996). Ringkasnya, 1µl antigen (feline C. psittaci galur Fe/145 dan Cello) diulaskan pada 12-well tefloncoated slide (Cell-line Associated Inc., Newfield, N.J., US) dan dikeringkan dalam suhu kamar dan difiksasi dengan methanol dingin selama 10 menit, dan 10 µl serum yang telah diencerkan (pengenceran secara seri kelipatan dua, dimulai dari 1 :4) diteteskan pada setiap lubang dan diinkubasikan pada suhu 37°C selama 60 menit. Setelah inkubasi slide dicuci tiga kali dengan PBS(-) selama 5 menit. Kemudian direaksikan dengan 10 µl fluorescenceisothiocyanate-conjugated goat anti-rat IgG (Cappel, conchraville, Pa., USA) yang telah diencerkan 20 kali dengan PBS(-) pada suhu 37° C selama 60 menit, dilanjutkan dengan pencucian tiga kali menggunakan PBS(-) selama 5 menit. Titer antibodi ditunjukan dari pengenceran serum tertinggi yang memperlihatkan perpendaran Chlamydia berwarna hijau. Kontrol positif diperoleh dari hyperimmune serum tikus putih yang disuntik dengan galur Fe/145. Serum tikus putih SPF yang tidak mengandung antibodi Chlamydia pada complement fixation test dan ELISA digunakan sebagai kontrol negatif.
Sampel serum tikus putih dikumpulkan pada saat sebelum vaksinasi dan seminggu setelah vaksinasi kedua (booster). Microimmunofluorescence test dilakukan mengikuti prosedur penelitian sebelumnya (Pudjiatmoko et al., 1996). Ringkasnya, 1µl antigen (feline C. psittaci galur Fe/145 dan Cello) diulaskan pada 12-well tefloncoated slide (Cell-line Associated Inc., Newfield, N.J., US) dan dikeringkan dalam suhu kamar dan difiksasi dengan methanol dingin selama 10 menit, dan 10 µl serum yang telah diencerkan (pengenceran secara seri kelipatan dua, dimulai dari 1 :4) diteteskan pada setiap lubang dan diinkubasikan pada suhu 37°C selama 60 menit. Setelah inkubasi slide dicuci tiga kali dengan PBS(-) selama 5 menit. Kemudian direaksikan dengan 10 µl fluorescenceisothiocyanate-conjugated goat anti-rat IgG (Cappel, conchraville, Pa., USA) yang telah diencerkan 20 kali dengan PBS(-) pada suhu 37° C selama 60 menit, dilanjutkan dengan pencucian tiga kali menggunakan PBS(-) selama 5 menit. Titer antibodi ditunjukan dari pengenceran serum tertinggi yang memperlihatkan perpendaran Chlamydia berwarna hijau. Kontrol positif diperoleh dari hyperimmune serum tikus putih yang disuntik dengan galur Fe/145. Serum tikus putih SPF yang tidak mengandung antibodi Chlamydia pada complement fixation test dan ELISA digunakan sebagai kontrol negatif.
HASIL DAN PEMBAHASAN
Pada proses ekspresi protein ompA-rekombinan, kondisi optimum yang diperoleh adalah sebagai berikut: setelah pembiakan awal dalam 3 ml TB pada suhu 37°C selama 6 jam, E. coli yang mengandung plasmid pRSETAgen ompA dibiakan kembali pada suhu yang sama dalam 50 ml TB selama 100 menit sehingga densitas-optiknya pada pembacaan OD 600 mencapai 0,4 saat yang paling tepat untuk dimulainya induksi dengan 1 mM IPTG. Protein ompA-rekombinan terbanya~ diperoleh setelah diinduksi pada suhu 37° C selama 180 menit.
Pada pemurnian bahan immunogen, protein ompA-rekombinan berikatan dengan resin ProBond™ dalam 20 mM larutan dapar fosfat, 500 mM NaCl pH 7,8, sedangkan sebagian besar protein sel induk semang (E. coli) tidak berikatan dengan resin ProBondTM. Sebagian kecil protein sel induk semang yang bisa berikatan dengan resin pada pH tersebut bisa dilepaskan dari resin ProBond™ dengan mudah menggunakan larutan dapat pH 6,0. Protein ompArekombinan dilepaskan dari resin ProBond™ dengan pencucian menggunakan larutan dapar pH 4,0.
Karena protein ompA-rekombinan yang dihasilkan insoluble (terdapat pada pelet setelah pelisisan sel) maka pemurnian protein dilakukan dalam kondisi denature dimana pada proses pelisisan sel digunakan guanidine hydrochloride. Untuk protein refolding dan mengembalikan kemampuan aktifitas protein tersebut, perlu dilakukan penyingkiran guanidine hydrochloride dalam suspensi ompA-rekombinan. Cara untuk menyingkirkan guanidine hydrochloride diIakukan dengan cara mendialisis suspensi ompA-rekombinan pada larutan dapat yang mengandung MgCI2, NaCl, KCl atau CaCI2
Dialisis dengan larutan dapar yang mengandung CaCl2 menyebabkan timbulnya banyak agregasi protein ompA-rekombinan sehingga protein yang dihasilkannya tidak baik untuk immunogen sehingga tidak digunakan sebagai vaksin. Dialisis menggunakan larutan dapar yang mengandung MgCl2 dan NaCl menimbulkan sedikit agregasi protein ompA-rekombinan. Sedangkan ompA-rekombinan sedikit sekali mengalami agregasi ketika didialisis menggunakan larutan dapar yang mengandung KCl. Hasil ini sesuai dengan hasil analisis immunobloting, band protein ompA-rekombinan yang didialisis dengan larutan dapar yang mengandung KCl terlihat lebih jelas dibanding dengan ompA-rekombinan yang didialisis dengan larutan dapar yang mengandung MgCl2 dan NaCl. Hasil-hasil ini menunjukkan bahwa larutan dapar yang mengandung KCl bisa dengan baik menyingkirkan guanidine hydrocloride dalam proses protein refolding sehingga protein ompA-rekombinan tidak rusak, bisa bereaksi dengan monoclonal antibody G-IB6 yang khas terhadap outer membrane protein C. psittaci dan bisa digunakan sebagai immunogen. Dialisis dengan larutan dapar 20 mM Tris pH 7,8 10% glycerol, 1 mM PMFS yang mengandung KCl bisa dipergunakan dalam pemurnian ompA-rekombinan.
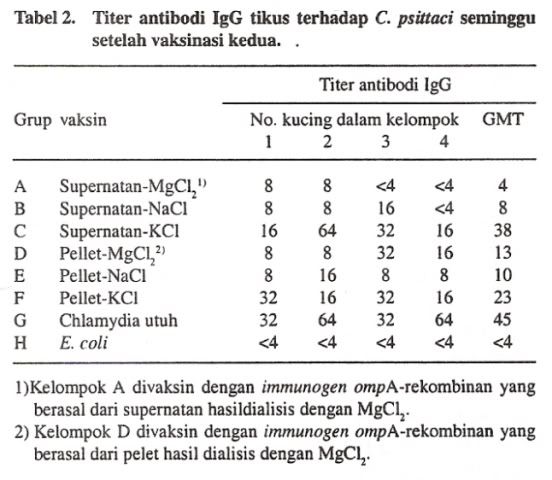
Untuk mengetahui immunogenisitas ompA-rekombinan, titer antibodi IgG serum tikus yang divaksin diukur dengan menggunakan microimmunofluorescence test. Sebelum dilakukan vaksinasi yang pertama semua tikus tidak mempunyai antibodi terhadap C. psittaci. Pada seminggu setelah vaksinasi kedua, tikus kelompok kontrol negatif tidak seekorpun yang mempunyai titer antibodi terhadap C. psittaci, sedangkan tikus dari kelompok C mempunyai geometric mean titer (GMT) tertinggi yaitu 1 :38, titer bervariasi antara 1: 16 dan 1 :64 (TabeI2). GMT yang kedua, tikus dari kelompok F yaitu 1:23 dengan kisaran titer antara 1:16 dan 1:32, diikuti kelompok D dengan GMT 1:13, dengan kisaran titer 1:8 dan 1:16, kemudian kelompok E dengan GMT 1: 10 dengan kisaran titer 1:8dan 1:16. Sedangkan kelopok A dan B mempunyai GMT masing-masing 1:4 dan 1 :8. Titer antibodi kelompok kontrol positif yang divaksin dengan vaksin yang mengandung Chlamydia utuh berkisar antara 1:32 dan 1:64 dengan GMT 1:45. Keberagaman titer kelompok satu dengan kelompok yang lain ini menunjukkan bahwa larutan dapar yang digunakan untuk dialisis mempengarui kwalitas immunogen yang dihasilkan.
Seminggu setelah vaksinasi kedua, 21 ekor dari 24 ekor yang divaksin dengan vaksin ompA-rekombinan mempunyai titer antibodi IgG terhadap feline C. psittaci.
Titer antibodi tersebut berkisar antara 1:8 sampai dengan 1:64. Baik material yang berasal dari pelet maupun dari supernatan bisa merangsang timbulnya antibodi IgG pada tikus. Tikus kelompok C yang divaksin dengan konsentrasi ompA-rekombinan tertinggi menunjukkan titer antibodi IgG yang tertinggi kemudian diikuti oleh tikus yang berasal dari kelompok F. Kedua kelompok C dan F tersebut merupakan kelompok yang divaksin dengan ompA-rekombinan yang didialisis dalam larutan dapar yang mengandung 0,1 M KCI. Tikus kelompok C divaksin dengan ompA-rekombinan yang berasal dari supernatan, sedangkan tikus dari kelompok F divaksin dengan ompA-rekombinan yang berasal dari pelet. Dari hasil penelitian ini menunjukkan bahwa vaksin ompA-rekombinan bisa menginduksi antibodi IgG terhadap feline C. psittaci.
Vaksin yang dibuat dari immunogen ompA-rekombinan yang didialisis dengan MgCl2 dan NaCl menimbulkan antibodi degan GMT kurang dari 1: 14. Sedangkan vaksin yang diperoleh dari protein yang didialisis dengan menggunakan KCl memperlihatkan kemampuan untuk menimbulkan terbentuknya IgG pada tikus cukup tinggi. Immunogen ompA-rekombinan yang berasal dari supernatan lebih banyak dari pada yang berasal dari pelet. Hal ini memperlihatkan bahwa protein ompA-rekombinan larut dalam denaturing elution buffer. Dari hasil-hasil ini menunjukkan larutan dapar dialisis yang mengandung KCl bisa digunakan dalam dialisis sehingga ompA-rekombinan bisa digunakan sebagai immunogen.
Pada studi kali ini vaksin yang mengandung Chlamydia 10 pangkat 7,0 ELD50 yang bisa merangsang terbentuk antibodi IgG cukup tinggi pada kelompok G. Hasil ini sesuai dengan hasil studi terdahulu tentang respon dosis vaksin inaktif yang menyatakan bahwa untuk memperoleh kekebalan yang cukup terhadap infeksi Chlamydia pada kucing, sebaiknya vaksin inaktif yang diberikan mengandung Chlamydia lebih besar lO pangkat 5,5ELD50 (Pudjiatmoko, 1999b). Titer antibodi yang diperoleh cukup tinggi pada kelompok C menunjukkan bahwa immunogen ompA-rekombinan bisa digunakan sebagai komponen utama vaksin Chlamydosis pada kucing. Untuk mengetahui potensi vaksin tersebut perlu dilakukan uji potensi menggunakan hewan percobaan kucing yang ditantang dengan Chlamydia hidup untuk mengetahui kekebalan yang ditimbulkan oleh vaksin ompA-rekombinan tersebut.
KESIMPULAN
Dari hasil penelitian ini dapat disimpulkan bahwa: (1) protein ompA-rekombinan Chlamydia yang digunakan sebagai komponen utama vaksin bisa merangsang timbulnya antibodi pada tikus putih. (2) Protein ompA-rekombinan feline Chlamydia dapat dimurnikan dengan Xpress system protein purification (Invitrogen BV, The Netherlands) menggunakan kolom resin ProBond™, (3) Larutan dapar 20 mM Tris pH 7,8 10% glycerol, 1 mM PMFS yang mengandung KCl bisa digunakan untuk dialisis ompA-rekombinan dalam mengeliminasi guanidine hydrochloride,dan (4) untuk menguji potensi vaksin ompA-rekombinasi Chlamydia perlu dilakukan studi respon immungenisitas ompA-rekombinan Chlamydia pada kucing dengan menggunakan tantangan Chlamydia hidup.
UCAPAN TERIMAKASIH
Penulis sampaikan terimakasih kepada Dr. Masubuchi Katsuo dan Dr. Iwamoto Kayo atas bantuan teknis yang diberikan dalam penelitian ini. Penelitian ini dibiayai oleh Society of Techno-inovation for Agriculture, Forestry and Fisheries (STAFF) Jepang.
DAFTAR PUSTAKA
Baker, J.A.A. 1942. A virus obtained from pneumonia of cats and its possible relation to the cause of atypical pneumonia in man. Science 96: 475-476.
Cello, R.M. 1967. Ocular infections in animal with PLT (Bedsonia) group agents. Am. J. Opthhalmol. 64: 1270-1273.
Everett, K.D.E., R.M. Bush, A.A. Andersen. 1999.
Emended description of the order Chlamydiales. proposal of Parachlamydiaceae fam. novo and Simkaniaceae fam. nov., each contammg one monotypic genus, revised taxonomy of the family chlamydiaceae, including a new genus and five new speies,and standards for the identification of organisms. Int. J. Syst. Bacteriol. 49: 415-440.
Hoover, E.A., D.E. Kahn, and J.M. Langloss. 1978. Experimentally induced feline chlamydia infection. Am. J. Vet. Res. 39: 541-547.
Hopkins, T.R. 1991. Physical and chemical cell discription for the recovery intercellular proteins. in: Purification and analysis of recombinant proteins (R. Seetharam and S.K. Sharma, eds.) pp 57-83. Marcell Dekker, New York.
Johnson, F.W.A. 1984. Isolation of Chlamydia psittaci from nasal and conjuctival exudate of a domestic cats. Vet. Rec. 114: 342--344.
Moulder, J. W., T.P. Hatch, C.-C. Kuo, J. Schachter, and J. Storz. 1984. Genus 1. Chlamydia Jones, Rake and Stearns 1945,55 AL. In: Krieg, N.R. and J.G. Holt (eds.) bargey's Manual of Systematic Bacteriology. Vol. 1, pp. 729-739. Williams and Wilkins. Baltimore.
Pudjiatmoko, H. Fukushi, Y. Ochiai, T. Yamaguchi, and K. Hirai. 1996. Seroepidemiology of feline Chlamydiosis by microimmunofluorescence assay with multipe strains as antigen. Microbiol. Immunol. 40:755-759.
Pudjiatmoko, H. Fukushi, Y. Ochiai, T. Yamaguchi, and K. Hirai. 1997. Phylogenie analysis of the genus Chlamydia based on 16S rRNA gene sequences. Int. J. Syst. Bacteriol. 47: 425-431.
Pudjiatmoko. 1999a. Studi awal pembuatan vaksin feline Chlamydiosis menggunakan protein rekombinan outer membrane protein A (ompA). Inovasi 8: 46-58.
Pudjiatmoko. 1999b. Respon dosis vaksin inaktif Chlamydiosis galur Fe/145 pada kucing. pp. 269-272. In: Proceeding of The 8th Scientific meeting of Indonesian Student Association, Osaka, Japan.
Sumber : Buletin Pengujian Mutu Obat Hewan nomor 8 tahun 2001 dan sekian itulah artikel Respon Pembentukan Antibodi pada Tikus Putih Terhadap Vaksin ompA-rekombinan Feline Chalmydiosis terimakasih ^_^
Tweet
Follow @kackdir